Traitements
Un travail d'équipe
Quelque soit le traitement proposé, le patient est toujours au centre des discussions et c'est à lui et à lui seul de décider. Les différents médecins et paramédicaux qu'il rencontre au cours de son parcours thérapeutique sont là pour l'informer de manière claire, loyale et appropriée dans le but de lui présenter les possibilités thérapeutiques envisageables ou non, selon les recommandations nationales et données scientifiques disponibles en France au moment de la discussion.
Chaque proposition thérapeutique est préalablement discutée et validée en Réunion de Concertation Pluridisciplinaire dédiée. Le médecin traitant du patient est mis au courant grâce à l'émission de courriers médicaux.
Le choix des traitements dépend des caractéristiques du cancer de chaque patient : l'endroit où il est situé, son stade, c'est-à-dire son degré d'extension, son type histologique, c'est-à-dire la nature des cellules à l'origine de la tumeur, et son grade, c'est-à-dire son degré d'agressivité ou sa capacité à évoluer.
S'il le souhaite, après informations et un temps de réflexion, le patient peut refuser toute prise en charge. Il a connaissance des risques et des conséquences de son choix sur sa santé.
Il est également tout à fait possible de demander un second avis dans un autre centre médical, qui sera à la charge du patient.
De multiples thérapeutiques
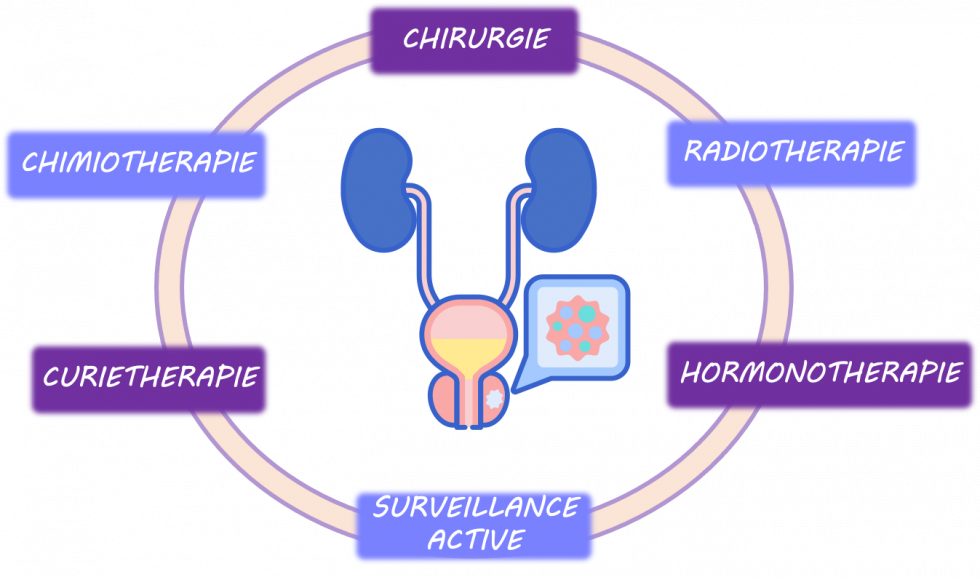
Selon le risque établi au diagnostic (faible, intermédiaire et haut) ainsi que le niveau d'extension de la maladie (stade localisé, localement avancé ou métastatique) mais également l'état de santé global du patient, plusieurs thérapeutiques d'efficacité identique peuvent être proposés. Il peut s'agit d'un seul type de traitement ou d'une association de plusieurs d'entre eux.
Les objectifs de ces thérapeutiques diffèrent selon le stade:
- surveiller l’évolution de la maladie pour retarder la mise en route d’un traitement (surveillance active)
- supprimer ou réduire la tumeur et/ou les métastases (chirurgie, radiothérapie, curiethérapie)
- réduire le risque de récidive (hormonothérapie)
- ralentir le développement de la tumeur ou des métastases (hormonothérapie, chimiothérapie)
Chacune de ces options est présentée et détaillée, avant sa mise en place, par le spécialiste concerné (chirurgien urologue, radiothérapeute ou oncologue) avec une consultation dédiée.
La surveillance active
Cette stratégie ne peut être proposé que lorsque:
- le cancer est asymptomatique
- et le risque de dissémination est faible
Son objectif est de retarder la mise en place d'un traitement, et les effets indésirables qui l’accompagnent, tant qu’il n’est pas nécessaire. En effet, certains cancers de la prostate évoluent lentement et ce, parfois, pendant longtemps.
Cette proposition est faite au patient par l'urologue qui peut la décliner et vouloir directement un traitement.
La surveillance active consiste à établir un rythme régulier et pré-définis de consultations avec l'urologue qui comprendront:
- le toucher rectal
- le dosage du PSA
- de nouvelles biopsies prostatiques
Si le patient devient symptomatique ou que le cancer de la prostate ne présente plus un des critères de la surveillance active, cette dernière est arrêtée et un traitement curateur (chirurgie, radiothérapie ou curiethérapie) est organisé.
La prostatectomie radicale
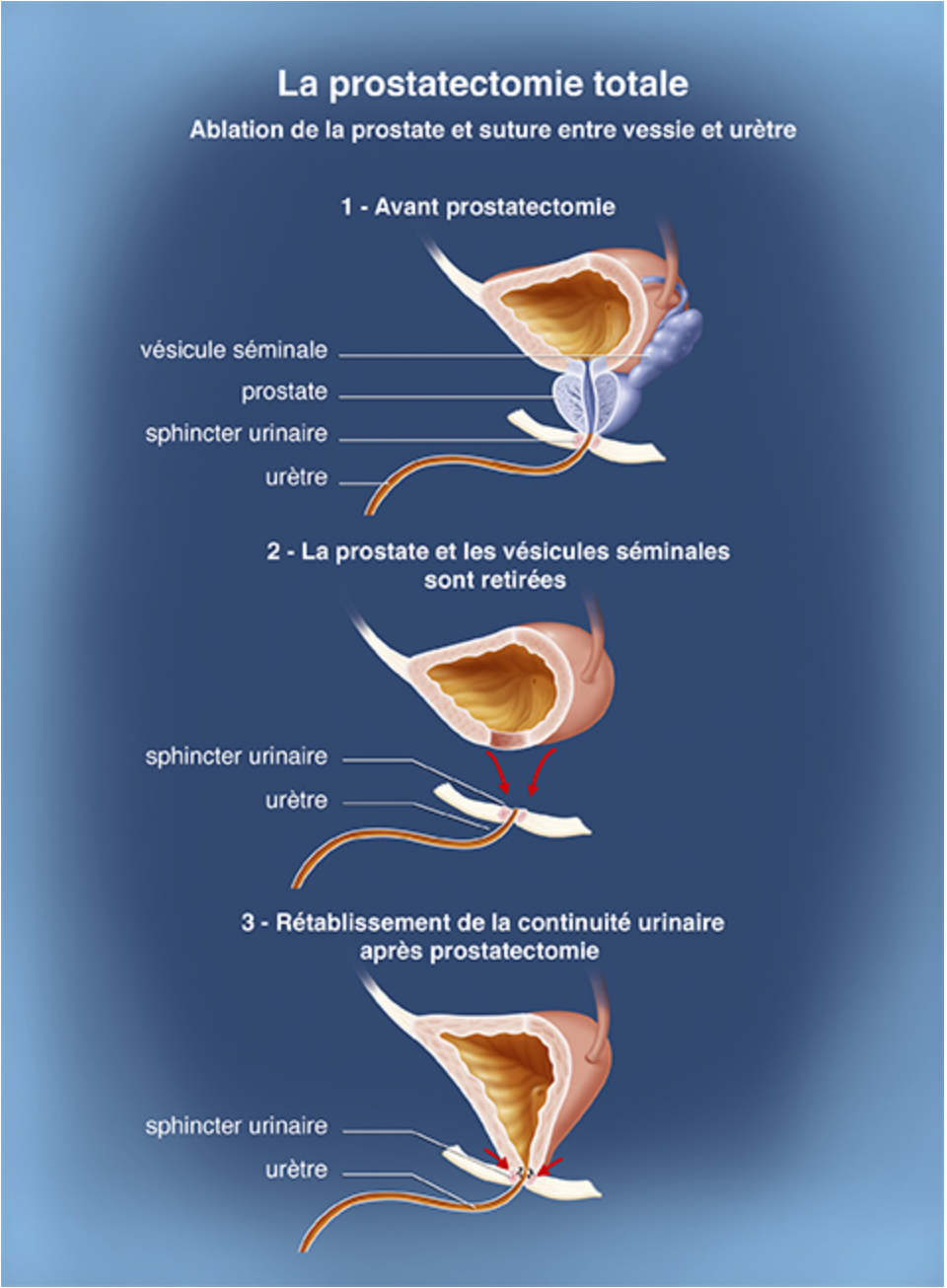
Le but de cette chirurgie est de retirer complètement la prostate, en emportant avec le cancer se situant à l'intérieur.
Cette chirurgie est expliquée par l'urologue.
Une consultation anesthésique et une prise de sang sont nécessaires avant. Elle est réalisée sous anesthésie générale. L’urologue retire la totalité de la prostate, ainsi que les vésicules séminales. Il rattache ensuite l’urètre à la vessie pour assurer l’écoulement des urines par les voies naturelles. Si nécessaire, dans le même temps opératoire, l’urologue enlève également les ganglions lymphatiques situés autour de la prostate: c’est le curage ganglionnaire.
Les nerfs et les vaisseaux sanguins qui permettent l’érection passent de chaque côté de la prostate. Ils forment les deux bandelettes neurovasculaires (ou vasculonerveuses). Dans la mesure du possible, ces bandelettes sont préservées par une technique de conservation des nerfs. Il peut cependant arriver qu’elles soient lésées au cours de l’intervention. Dans certains cas, quand les cellules cancéreuses sont très proches, il est nécessaire de les enlever.
Après la chirurgie, une sonde urinaire est laissée en place quelques temps puis est retirée.
La prostatectomie radicale est indiquée en l'absence de métastases et au risque faible/ intermédiaire/ élevé.
Un curage ganglionnaire est nécessaire en cas de risque intermédiaire et élevé.
Après une prostatectomie radicale, le PSA doit devenir indosable.
Pour plus d'informations, vous pouvez consulter les Fiches Patient de l'Association Française d'Urologie:
La radiothérapie externe
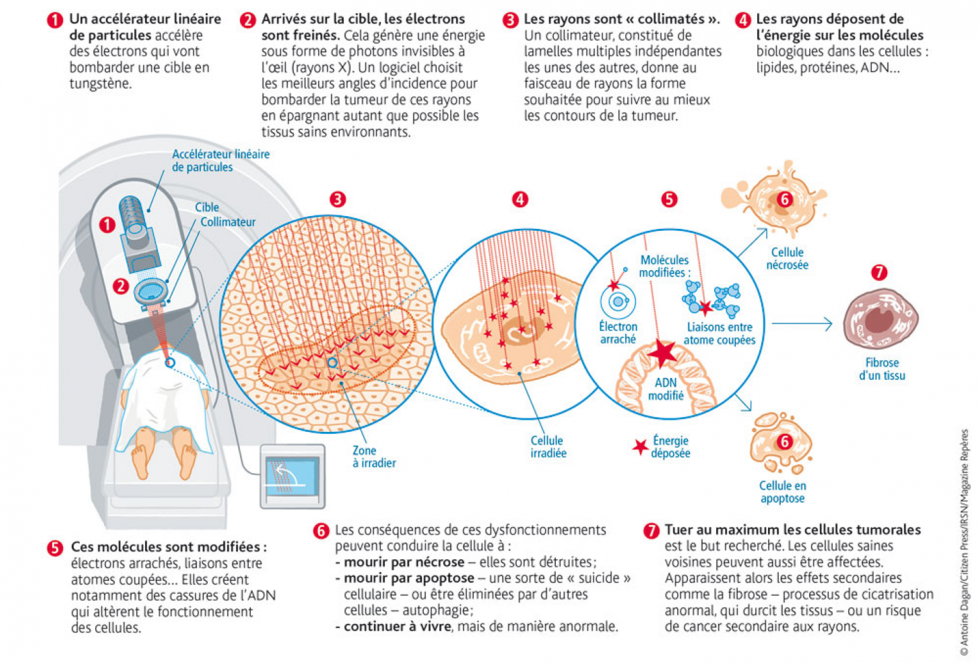
Généralités
La radiothérapie utilise des rayonnements pour détruire les cellules cancéreuses en les empêchant de se multiplier. Ce traitement consiste à diriger précisément ces rayonnements ionisants (appelés aussi rayons ou radiations) sur les cellules cancéreuses, tout en préservant le mieux possible les tissus sains et les organes avoisinants. Ces rayonnements, produits par un accélérateur de particules, sont dirigés en faisceau vers la vessie pour atteindre la tumeur et les ganglions voisins à travers la peau.
Indication
Pour les cancers de la prostate localisés à risque faible, la radiothérapie externe, utilisée seule, est un des traitements de référence.
Pour les formes localisées à risque intermédiaire, la radiothérapie externe peut être associée, dans certains cas, à une hormonothérapie courte (jusqu’à 6 mois).
Une radiothérapie externe est un des traitements possibles des formes localisées à haut risque ; elle est le traitement de référence des cancers localement avancés. Dans ces deux situations, elle est associée à une hormonothérapie de longue durée (jusqu’à 3 ans).
A noter qu'en cas de récidive biologique post chirurgie (ascension du PSA après une prostatectomie radicale), une radiothérapie externe sur la loge prostatique peut être réalisée.
Une radiothérapie externe peut parfois être utilisée pour cibler certaine métastases, notamment au niveau de l'os.
En pratique:
En général les séances de radiothérapie sont quotidiennes, 5 fois par semaine.
Elle comporte plusieurs étapes dont l’ensemble porte le nom de plan de traitement.
- Imagerie: Un scanner ou une IRM préparatoire est programmé. Il permet au radiothérapeute de définir très précisément la façon dont l’appareil de radiothérapie devra être utilisé pour déterminer la dose et le nombre de séances nécessaire pour détruire la tumeur tout en préservant au mieux les zones saines.
- Mise en place : Entre cet examen préparatoire et les différentes séances de radiothérapie, la position du patient doit être scrupuleusement identique. Pour cela, un point de marquage (tatouage ou marqueur) peut servir de repère. Un masque de contention, une fois placé sur la tête, aide le patient à être parfaitement immobile lors des différentes séances.
- Consultations: Tout au long du traitement, le radiothérapeute vous voit en consultation au moins une fois par semaine pour répondre à vos questions, vous examiner et prendre en compte les effets secondaires éventuels.
- Vérification hebdomadaire: Au moins une fois par semaine, un examen d’imagerie est réalisé pour vérifier la trajectoire des rayons et la position dans laquelle vous êtes à chaque séance.
Après un traitement de la prostate par radiothérapie externe, le PSA doit diminuer.
La curiethérapie
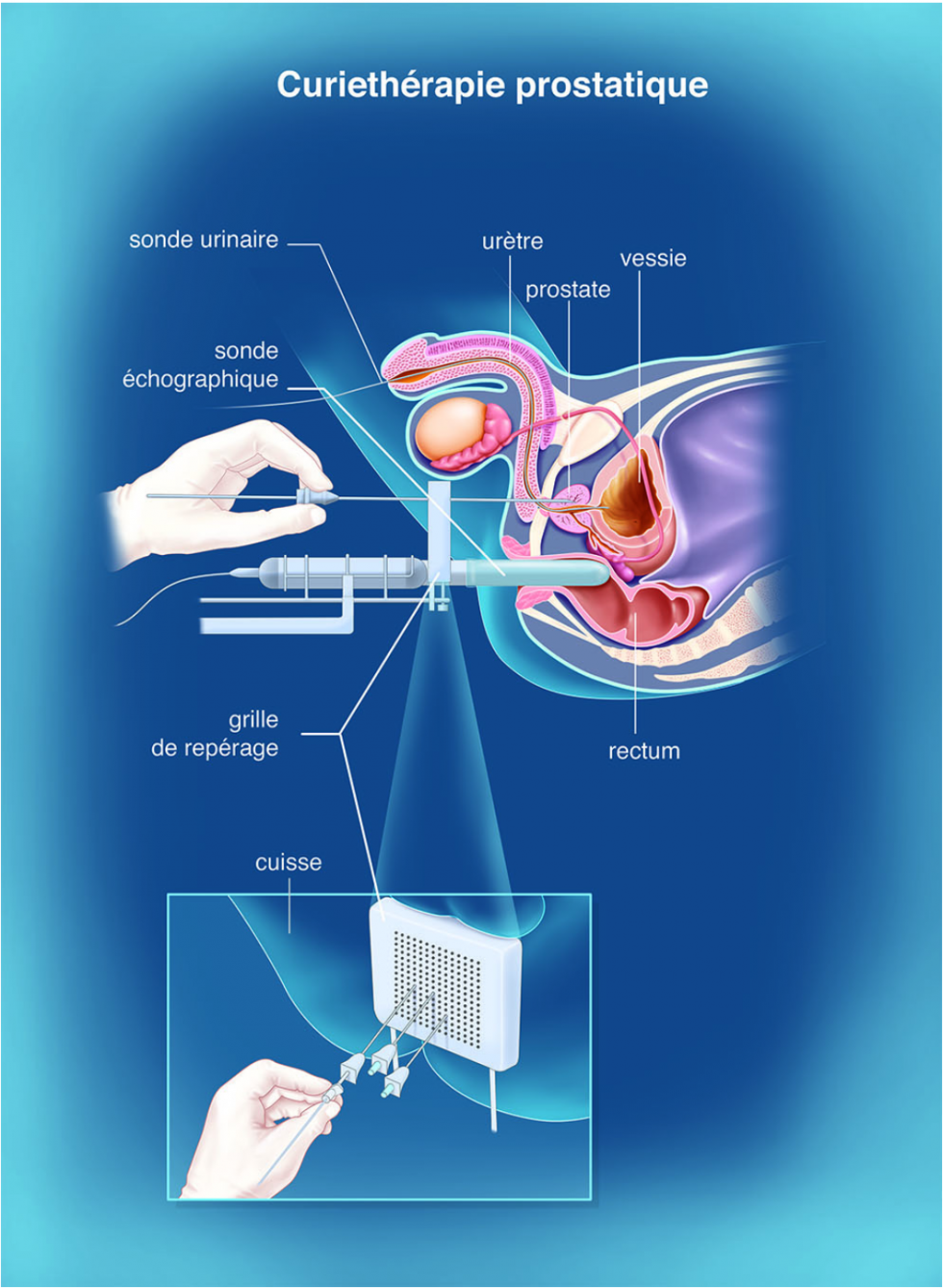
La curiethérapie prostatique consiste à mettre en place, dans la prostate, un élément radioactif et ce directement au contact de la zone à traiter. Pour cela, l'élément radioactif, qu'on appelle aussi source radioactive, est inséré dans un applicateur, lui-même introduit dans le corps.
Du fait de sa radioactivité, la source libère spontanément au cours du temps des rayons qui vont détruire les cellules cancéreuses. La curiethérapie permet de délivrer de façon très ciblée et localisée des doses très élevées de rayons (plus élevées que lors d'une radiothérapie externe).
Il existe deux formes de curiethérapie :
- par implants permanents de grains d’iode 125 (les grains radioactifs restent définitivement implantés dans la prostate). Il n'y aucun risque pour votre entourage une fois à domicile.
- par implants temporaires, le plus souvent de sources d’iridium 192. On parle aussi de technique à haut débit de dose. Après l'irradiation, plus aucune source radioactive ne reste dans la prostate.
Ce traitement est expliqué par le radiothérapeute et nécessite une anesthésie générale avec une hospitalisation d'une nuit. Une consultation anesthésique, un examen cyto-bactériologique des urines et une prise de sang sont nécessaires avant ce geste.
La curiethérapie prostatique peut être proposée dans les cancers de prostate de stade localisé avec un risque faible ou intermédiaire.
L'hormonothérapie
Généralités
Ce traitement est basé sur une spécificité du cancer de la prostate qui est son hormonosensibilité: il s'agit d'un cancer qui est très sensible à l'action de certaines hormones - les androgènes - et particulièrement à celle de la testostérone. Les cellules cancéreuses utilisent la testostérone comme une sorte de "carburant" qui leur permet de se multiplier plus rapidement.
L'hormonothérapie est le traitement qui vise à supprimer l'action de la testostérone (et des autres androgènes) sur les cellules prostatiques cancéreuses afin d'inhiber leur prolifération.
DES hormonothérapies
Pour bien comprendre le mécanisme d'action, il faut savoir que 95% de la testostérone est produite par les testicules. Les 5% restants sont produits par les surrénales.
Il existe différents types d'hormonothérapie:
- l'hormonothérapie de 1ère génération supprime la production de testostérone par les testicules. Il s'agit la plupart du temps d'injection sous-cutanée qui sont réalisées tous les mois ou 3 ou 6 mois suivant le médicament choisi.
- l'hormonothérapie dite de 2nd génération est un traitement par voie orale, quotidien, dont la planification et la surveillance sont incluses dans le Centre de Thérapies Orales au CHU de Limoges. Elle peut être de 2 types:
- soit par suppression de la production de testostérone au niveau de la surrénale
- soit par suppression de l'effet de la testostérone dans les cellules prostatiques cancéreuses
Il est important de savoir également que l'on peut supprimer la production de testostérone par les testicules en retirant chirurgicalement ces deux derniers. Il s'agit d'une chirurgie simple et réalisée le plus souvent sous anesthésie locorégionale par une petite incision pratiquée dans le scrotum.
L'ablation des testicules et l'hormonothérapie de 1ere génération sont équivalents dans la suppression de production de la testostérone, chacun ayant ses avantages et ses inconvénients que le chirurgien urologue détaille au patient.
Indications
Au stade localisé, une hormonothérapie de 1ère génération est indiquée avec la radiothérapie externe:
- durant 6 mois dans les formes à risque intermédiaire
- durant 3 ans dans les formes à haut risque
Au stade localement-avancé, l'hormonothérapie de 1ère génération est également indiquée en association avec la radiothérapie externe durant 3 ans.
Après traitement (curiethérapie, radiothérapie externe ou prostatectomie) et en cas d'élévation du PSA sans métastase décelable aux imageries, une hormonothérapie de 1ere génération est nécessaire, à vie.
Dans le cas d'un stade métastatique, l'hormonothérapie de 1ère génération est également prescrite à vie et trés souvent avec une hormonothérapie de 2nd génération.
L'hormonothérapie de 2nd génération est donc prescrite au stade métastatique et toujours en association avec l'hormonothérapie de 1ere génération.
La chimiothérapie
La chimiothérapie est indiquée lorsque des métastases sont diagnostiquées.
Elle est toujours associée à une hormonothérapie.
Avant tout traitement, le patient rencontre l'oncologue médical. Cette consultation est importante de part et d'autre:
- pour l'oncologue: il évalue l'état général du patient et recherche s'il existe des contre-indications ou des particularités qui pourraient interdire une thérapeutique ou nécessiter une adaptation (dans la posologie ou le rythme d'administration des traitements par exemple).
- pour le patient: il est informé des différentes possibilités thérapeutiques avec leurs objectifs et leurs effets secondaires possibles. Il peut poser ses questions et être accompagné (par un proche, par sa personne de confiance, par son curateur ou tuteur...)
A l'issue de la consultation, le patient se voit remettre une fiche d'information sur son traitement, un Plan Personnalisé de Soins et les ordonnances nécessaires au bon déroulement de son traitement.
Suite à ce temps médical, le patient rencontre une Infirmière Diplômée d'Etat (IDE) qui reprend avec lui les informations données par le médecin, revient sur certains points clefs, anticipe les rendez-vous, propose l'accès aux Soins de Support et répond bien entendu aux questions.
Fonctionnement et types de chimiothérapies
Une chimiothérapie est un médicament, délivrée le plus souvent par les veines, qui permet de détruire les cellules cancéreuses dans le corps du patient qui la reçoit. La chimiothérapie empêche la division d'une cellule cancéreuse, cette dernière n'est alors plus viable et est détruite.
Du fait du passage dans tout le corps, la chimiothérapie peut agir sur toutes les cellules cancéreuses, qu'elles aient été détectés par un scanner ou non. C'est un traitement systémique par opposition aux traitements locaux (chirurgie, radiothérapie...).
Il existe plusieurs types de chimiothérapies: chacune agit différemment pour empêcher la division des cellules cancéreuses. C'est pour cela que les chimiothérapies ne sont pas identiques d'un cancer à un autre.
Le plus souvent, un traitement par chimiothérapie est une combinaison de plusieurs chimiothérapies. On parle alors de protocole de chimiothérapies. Dans chaque protocole, chaque chimiothérapie est réalisée à un temps donné, selon des conditions strictes, établies de manière nationale sur la base de données scientifiques approuvées.
Pour permettre le passage dans le sang des produits de chimiothérapies, il est nécessaire de mettre en place chez le patient un abord veineux fiable. Deux principales techniques sont proposées:
- pose d'un site veineux implantable ou chambre implantable
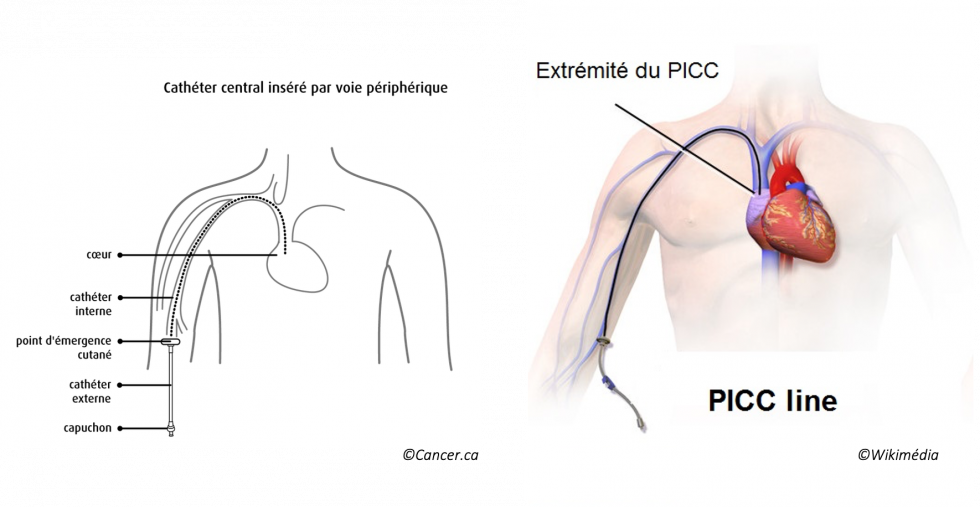
- pose d'un PICC-Line (Peripherally Inserted Central Catheter Line) ou Cathéter Central à Insertion Periphérique
Chacun présente des avantages et des inconvénients qui sont exposés au patient par l'oncologue.
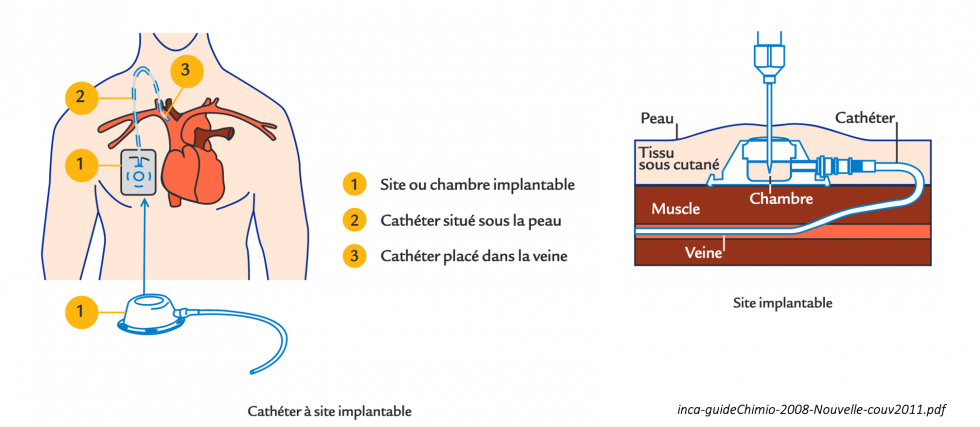
Ce dispositif est composé d’un petit boîtier, la chambre implantable, et d’un tuyau souple et fin appelé cathéter. Ce dispositif est placé sous la peau, au cours d’une courte intervention chirurgicale et sous anesthésie locale. À chaque perfusion, les médicaments sont injectés directement dans la chambre implantable au travers la peau. Ce dispositif reste en place pendant toute la durée du traitement et permet d’avoir une activité physique normale (se laver, voyager…)
Il s’agit d’un cathéter veineux central inséré au-dessus du pli du coude dans une veine périphérique. Le point d’insertion du PICC Line doit surveillé quotidiennement en milieu hospitalier et 1 fois par semaine par l’équipe soignante qui s’occupe de vous à domicile. C’est pour cette raison qu’un pansement transparent sera posé dès que possible sur le point d’orifice du PICC Line. Il permet une surveillance directe du point d’insertion du dispositif.
Les essais cliniques (ou essais thérapeutiques)
Selon le souhait du patient et l'évaluation clinico-biologique de l'oncologue médical, il peut être proposé la participation à des essais cliniques.
Le but est l'accès à des thérapeutiques innovantes, généralement ciblées, non encore disponibles de manière usuelles en France.
Il s'agit d'une proposition réalisée par l'oncologue, cela n'est pas obligatoire.
Ces essais peuvent être réalisés sur Limoges ou dans d'autres centres suivant la disponibilité de l'essai clinique.
- Si l'essai est disponible sur Limoges, le patient est amené à rencontrer un oncologue médical membre de l'Unité de Recherche Clinique en Oncologue (URCO), qui est différent de son oncologue médical habituel. Cela ne veut pas dire que ce dernier arrête de suivre le patient; au contraire, le suivi devient double.
Le médecin de l'URCO informe de manière détaillée, à la fois orale et écrite, le patient et répond à ses questions. Il vérifie également qu'il n'existe pas de contre indications à l'inclusion dans l'essai clinique.
Après signature du consentement éclairé par le patient, l'inclusion est réalisée et le traitement peut être effectué sur Limoges.
- Si l'essai n'est pas disponible sur Limoges, l'oncologue médical et le patient choisissent ensemble le centre le plus proche proposant le ou les essais cliniques voulu(s). Le patient se rend ensuite dans le centre spécifique et le reste de la prise en charge est identique à celle effectuée sur Limoges mais réalisée exclusivement dans ce centre.
